てんかん
てんかんとは
てんかんは、けいれんや意識消失などのてんかん発作を繰り返し起こす脳の慢性疾患です。てんかん発作は、普段は規則正しいリズムを繰り返している脳の電気的な活動に乱れが生じ、脳の神経細胞に突発的な興奮が発生することで起こります。てんかんのある方は100人に1人といわれ、誰でもかかる可能性のある頻度の高い病気です。大半の方は適切な薬物治療により発作が起こらない生活ができるようになります。しかし中には一定期間適切な薬物治療を続けても発作を抑制できない難治性てんかんの患者さんもいらっしゃいます。
てんかんは、幅広い年齢層の方が罹病します。また、てんかんには他の身体・精神症状が随伴していることもあり、てんかん発作を抑制するのみでは問題が解決できない場合もあります。このような問題に対して、当院では複数科の医師、臨床検査技師、看護師、リハビリテーションスタッフ、臨床心理士など様々な職種のスタッフが協力して、包括的な診療・支援に取り組んでいます。詳細につきましては、広島大学病院てんかんセンターのホームページをご参照ください。
このホームページでは、当科で行っているてんかんの検査(一部関連施設でも行っています)および難治性てんかんに対する手術についてご紹介します。
てんかんの検査
てんかん発作は神経細胞の過剰な活動による症状ですが、様々な原因や病型があります。診察時に発作が起こることは稀であり、診断に難渋することも多くあります。特に薬剤で発作が抑制できない難治性てんかん患者さんの手術計画を立てる上では、患者さんそれぞれのてんかん病態を詳細に把握することが重要です。また、てんかん自体の診断が難しい患者さんの正しい診断を得るために詳細な検査を行うこともあります。当科では、下記のような様々な検査法を用いててんかんの診断や病態把握、さらに脳の中で発作を引き起こしている部位(てんかん焦点)の特定を行っています。
長時間ビデオ脳波モニタリング
患者さんの頭皮に脳波用の電極を接着してもらい脳波と発作時のビデオを同時に記録する検査です。数日~7日間継続して行います。日頃の発作頻度が少ない患者さんでは抗てんかん薬を徐々に減量して発作を起こりやすくさせることもあります。発作が起こった時の症状と脳波所見を確認することで、てんかん発作が脳のどの部位から生じ、どのように拡がっていくのか、など詳しい病態を知ることができます。個室で行う検査で、患者さんにはベッド上で過ごしていただきますが、テレビを見たり、本を読んだりすることもでき、トイレも通常どおり可能です。ただし、入浴はできません。
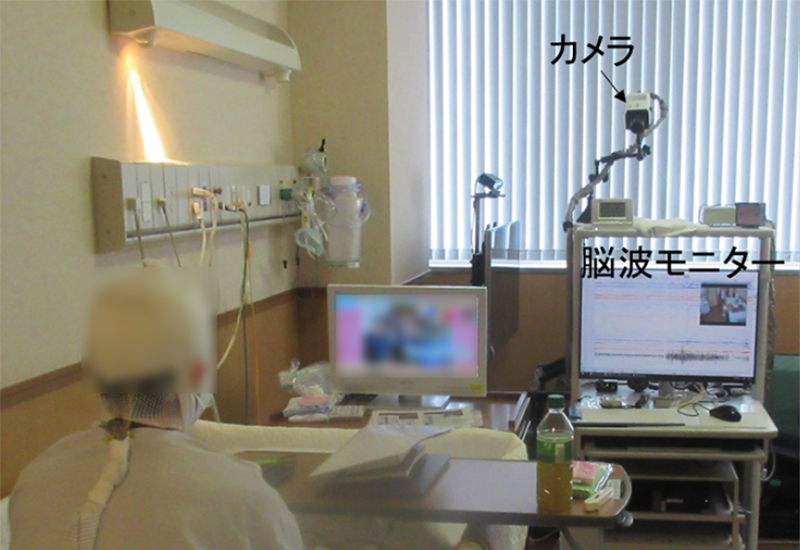
長時間ビデオ脳波モニタリング中の風景です

発作時の脳波です。青色が脳の左半球、赤色が右半球です。オレンジ色で示したところが発作波であり、左側頭部から発作が始まっていることがわかります。
形態学的検査(MRI,CT)
脳の形態学的な異常を調べる検査で、高磁場(3テスラ)MRI装置を用いて行います。MRIでなんらかの病変があれば、てんかん焦点特定の重要な手がかりとなります。過去にMRIで異常なしと言われていても、脳波や他の検査結果と照らし合わせると軽微な異常が判明することもあります。また、てんかん焦点になりやすい海馬を調べるときには、視認だけではなく、より厳密に海馬体積の測定も行っています。生体内に金属が入っているなどの理由でMRIが施行できない場合はCT検査で評価することもあります。
核医学検査(フルオロデオキシグルコースPET,イオマゼニルSPECT)
フルオロデオキシグルコースPET(FDG-PET)は脳の糖代謝を調べる検査です。てんかん焦点およびその周辺では糖代謝が低下することが知られています。イオマゼニルSPECT(IMZ-SPECT)は脳内の中枢性ベンゾジアゼピン受容体の分布を評価する検査です。FDG-PET検査と同様に、てんかん焦点ではイオマゼニルの集積低下がみられます。

FDG-PET
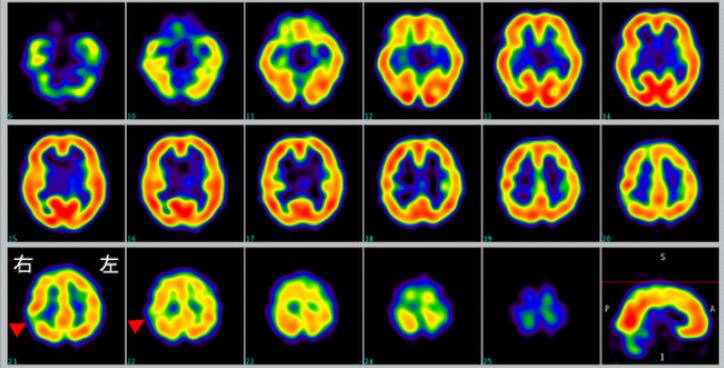
IMZ-SPECT
FDG-PETでは左前頭葉の糖代謝が低下しています。IMZ-SPECTでは右頭頂葉にイオマゼニル集積低下が認められます。
脳磁図(MEG)検査
脳の電気的な活動によって生じる微弱な磁場を捉える検査方法です。頭皮上に出てくるわずかな電磁波を利用し、てんかん焦点の位置を予測するのに大変有用な検査です。脳波と違って脳から出てくる信号が頭蓋骨や髄液、皮膚などで減衰したり歪められたりすることがありません。また、多くのセンサーを用いて測定しますので空間分解能が高く、脳波よりも詳細な焦点局在診断が可能です。
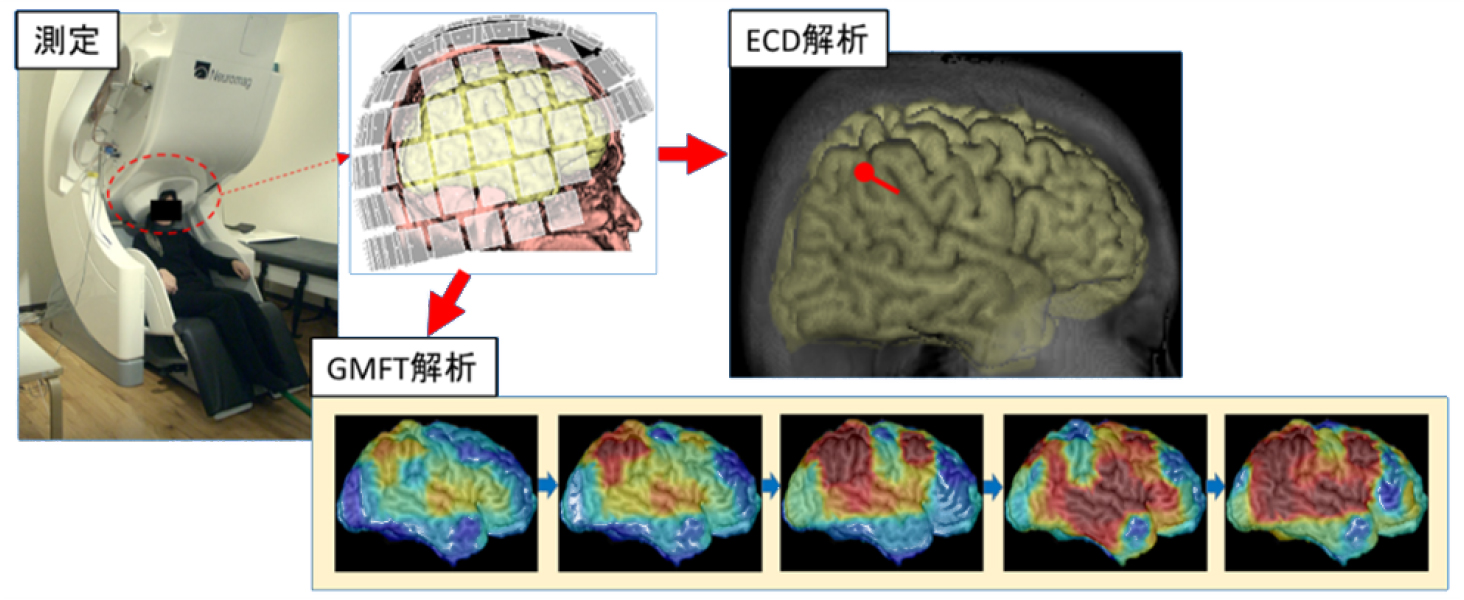
測定は椅子に座った状態、または臥床した状態で行います。等価電流双極子解析(ECD解析)はてんかん活動の中心を点として表します。当院では独自に開発した傾斜磁場トポグラフィ解析(GMFT解析)を用いててんかん活動の時間・空間変化を詳細まで評価しています。
神経心理学的検査
長期間てんかん発作が継続すると、脳機能に悪影響を及ぼすことがあります。その影響を調べるために、認知機能や記憶力などの高次脳機能を数値化して評価します。外科治療を行う場合には、これらの検査結果をもとに、手術に伴う高次脳機能障害を回避できるように治療計画を立てます。
ワダテスト
言語機能や記憶の中枢が左右どちらの脳にあるのかを調べる入院して行う検査です。大腿部の血管からカテーテルを入れて、左右それぞれの脳の動脈に薬剤を注入し一時的に脳を麻痺させて機能の左右差を見ます。てんかん焦点切除術を計画する場合に必要な検査です。
難治性てんかんに対する根治的な外科治療
複数の抗てんかん薬を用いても一定期間(成人では1年が目安)以上てんかん発作が抑制されないてんかんを難治性(薬剤抵抗性)てんかんと言います。こうした患者さんでは外科治療を考慮します。てんかん焦点が前述のような検査で診断ができて、その部位を切除しても後遺症の心配がないか、あっても軽い症状で受け入れが可能な場合に、根治的な治療であるてんかん(皮質)焦点切除術の適応となります。当院では手術中に、正確な位置を示すナビゲーションシステムや運動神経などのモニタリングを併用して、安全な手術を行っています。広島大学病院てんかんセンターホームページでも「てんかんの手術 -知っておきたい症状と方法-」を掲載していますので、ご参照ください。
内側側頭葉てんかん
主に海馬、扁桃体などの側頭葉内側部にてんかん焦点が存在する、成人の難治性てんかんで最も多いてんかんです。原因には海馬硬化症の他に良性腫瘍や皮質形成異常などがあります。内側側頭葉てんかんに対する側頭葉切除術については2001年に海外で行われた無作為化比較試験において薬剤治療に対する優位性が示されており1)、高い有効性と安全性をもった確立された治療法です。一般的な側頭葉切除術の他に、記憶力温存のために切除範囲を縮小した選択的海馬扁桃体切除術を行うこともあります。


海馬硬化症のMRIです。左海馬が委縮し、高信号となっています。
新皮質てんかん
大脳半球(前頭葉、側頭葉、頭頂葉、後頭葉)の皮質に焦点が存在しているものを新皮質てんかんと呼びますが、焦点の部位によって様々な発作症状を起こしてきます。原因となる病変の種類も様々ですが、MRIで病変が認められれば、焦点特定の手がかりとなります。海外の報告では、MRIで病変が認められる場合の手術による発作消失率は約70%で、病変が認められない場合は約40%となっています2)。前述のようないろいろな検査を組み合わせて焦点を特定し、手術に臨みますが、多くの場合では2回の手術が必要となります。まず1回目の手術で開頭を行って、頭蓋内に電極を設置します。その後、頭蓋内電極を利用した長時間ビデオ脳波モニタリングを行い、てんかん焦点の詳細な特定と切除範囲を決定して2回目の手術でてんかん焦点を切除します。当科では初回手術から2週間後に2回目の手術を行っています。もし、てんかん焦点の範囲が広い場合や、運動野、言語野などの機能領域にまたがっている場合などでは、焦点のすべてを切除できない場合や、切除自体ができないこともあります。

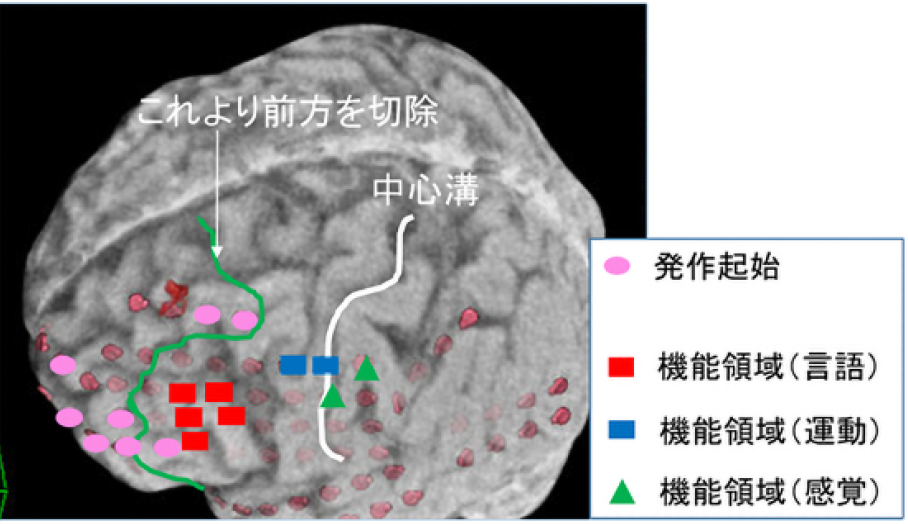
図1は、頭蓋内電極を設置した際の写真です。図2は、頭蓋内ビデオ脳波モニタリングの結果からてんかん焦点を特定し、切除範囲を計画している様子を示しています。
片側半球の広範な病変による部分てんかん
孔脳症、ラスムッセン脳炎、スタージ・ウェーバー症候群、皮質形成異常、片側巨脳症などによりてんかん焦点が一側の大脳半球広範に及んでいる場合、半球離断術が行われることがあります。離断する大脳半球の機能がすでに廃絶していることが手術を行う上での前提です。しかし、わずかな機能が残っている場合でも特に小児では、発作が重篤であったり、健側の大脳半球への悪影響で脳機能や発達が阻害されることが懸念されたりする場合には、手術後の機能回復を期待して手術を行うこともあります。
難治性てんかんに対する緩和的外科治療
てんかん焦点が広範囲であったり、機能中枢と重なっていたりという理由で根治的な焦点切除術ができない場合や、過去に焦点切除を行ったが発作抑制が不十分な場合に、発作を緩和する目的で行われます。発作の重症度を減弱させたり、頻度を減少させたりすることで、患者さんの日常生活の質を改善させることを目指す治療です。発作軽減により精神活動性の向上が得られる可能性もあります。
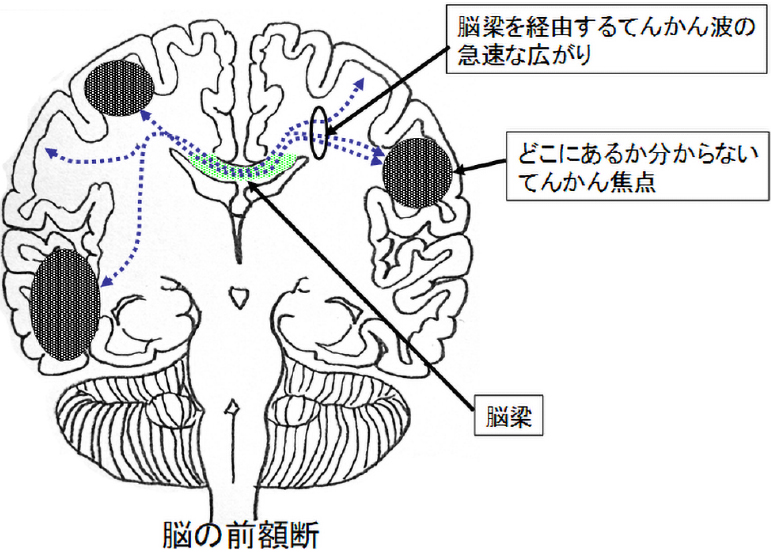
脳梁離断術
脳梁は左右の大脳半球をつなぐ交連線維の太い束です。一側の大脳から発生した発作が短時間のうちに脳梁を介して対側大脳に波及することにより、転倒するような危険な発作が生じることがあります。このような場合、脳梁を離断することで発作症状の軽減が期待できます。転倒を伴う発作(脱力発作)に対して最も有効ですが、てんかん性スパズム、強直発作、強直間代発作、脱力発作なども対象となります。小児では、基本的に脳梁全離断を行います。成人の場合は、患者さんの状態に応じて脳梁の前方部分のみを離断する場合もあります。
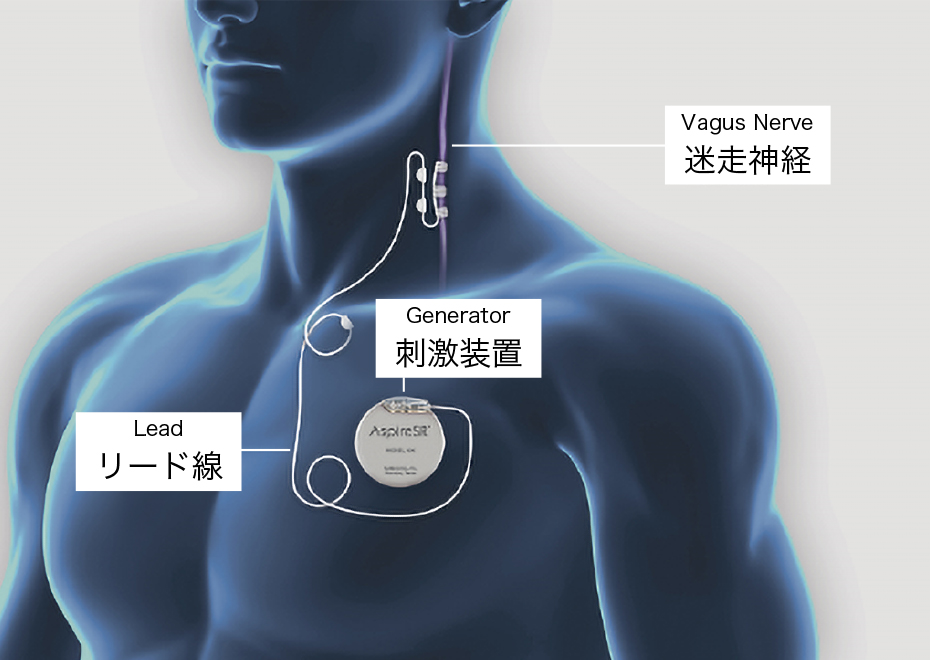
迷走神経刺激療法(VNS)
世界的にも広く普及している治療法であり日本では2010年に保険承認された手術です。左頸部の迷走神経に電極を巻き付けて固定し、刺激装置を前胸部に留置します。迷走神経を介した電気刺激を脳に伝えて、てんかん発作を抑制します。VNS治療を受けられた50~60%の患者さんで50%以上の発作頻度減少が得られ、治療を長期継続することでさらに高い治療効果が得られることが報告されています。新たにVNSを設置した場合、当初は2~4週ごとに刺激強度を上げていきます。その後は約3カ月に1回くらいの通院で、刺激状態のチェックをします。
診療実績
下記は、当グループで施行した長時間ビデオ脳波モニタリングの件数です(一部、連携施設での件数を含みます)。
← 横スクロールでご覧ください →
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2019年 | 2020年 | 2021年 | |
|---|---|---|---|---|---|---|---|---|
| 頭皮上ビデオ脳波モニタリング | 60 | 71 | 64 | 64 | 84 | 80 | 53 | 67 |
| 頭蓋内ビデオ脳波モニタリング | 3 | 6 | 7 | 4 | 7 | 8 | 5 | 2 |
当院は、広島県において唯一のてんかん外科手術実施施設です。下記は、当グループの手術件数です(一部、連携施設での手術を含みます)。
← 横スクロールでご覧ください →
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2019年 | 2020年 | 2021年 | |
|---|---|---|---|---|---|---|---|---|
| 慢性頭蓋内電極留置術 | 3 | 6 | 7 | 4 | 7 | 8 | 5 | 2 |
根治的外科治療
← 横スクロールでご覧ください →
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2019年 | 2020年 | 2021年 | |
|---|---|---|---|---|---|---|---|---|
| 選択的海馬扁桃体切除術 | 5 | 4 | 3 | 1 | 2 | 1 | 1 | 4 |
| 前側頭葉切除術 | 2 | 7 | 4 | 1 | 4 | 7 | 7 | 0 |
| 側頭葉外皮質切除術 | 2 | 5 | 6 | 5 | 6 | 8 | 3 | 2 |
| 病巣切除術 | 1 | 3 | 2 | 0 | 2 | 2 | 0 | 0 |
| 多葉離断術 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 |
| 半球離断術 | 1 | 1 | 0 | 0 | 2 | 2 | 1 | 0 |
緩和的外科治療
← 横スクロールでご覧ください →
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2019年 | 2020年 | 2021年 | |
|---|---|---|---|---|---|---|---|---|
| 脳梁離断術 | 7 | 10 | 8 | 2 | 10 | 11 | 12 | 14 |
| VNS設置術 | 20 | 14 | 13 | 8 | 10 | 8 | 4 | 6 |
| VNS入替術 | 0 | 0 | 0 | 6 | 11 | 9 | 12 | 7 |
← 横スクロールでご覧ください →
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2019年 | 2020年 | 2021年 | |
|---|---|---|---|---|---|---|---|---|
| その他 | 4 | 4 | 6 | 1 | 8 | 2 | 2 | 7 |
← 横スクロールでご覧ください →
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2019年 | 2020年 | 2021年 | |
|---|---|---|---|---|---|---|---|---|
| 手術総数 | 45 | 52 | 50 | 29 | 63 | 58 | 48 | 35 |
参考文献
- Wiebe S, Blume WT, Grivin JP, et al. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 2001; 345: 311-318.
- Téllez-Zenteno JF, Hernández Ronquillo L, Moien-Afshari F, et al. Surgical outcomes in lesional and non-lesional epilepsy: a systematic review and meta-analysis. Epilepsy Res. 2010; 89: 310-318


